
Termodinâmica é o ramo da física que responsável pelo estudo da energia térmica (muitas vezes também conhecida como “energia interna”) de sistemas físicos. Os fenómenos termodinâmicos são uma parte importante da nossa vida diária: quando aquecemos alimentos, quando os embrulhamos se está frio lá fora ou se entramos num local com ar condicionado, estamos a experimentar a termodinâmica em primeira mão.
Todos os sistemas macroscópicos possuem uma propriedade chamada “temperatura” que é uma medida da energia interna que possuem e que é diferente do zero absoluto (-273 °C). Os corpos tendem sempre a encontrar equilíbrio com o seu meio envolvente e/ou com outros corpos com os quais têm contacto, quando dois corpos que têm temperaturas diferentes entram em contacto vão sempre atingir o que se chama “equilíbrio térmico”, ou seja, um ponto em qual ambos os corpos igualam suas temperaturas.
Isso é conhecido como a “lei zero” da Termodinâmica, que afirma: se dois corpos A e B estão cada um em equilíbrio térmico com um terceiro corpo C, então os corpos A e B também estão em equilíbrio.
O que essa lei da termodinâmica quer nos dizer é justamente que os corpos sempre tendem a igualar suas temperaturas e atingir o equilíbrio térmico. Essa lei foi comprovada experimentalmente repetidas vezes, e nós a experimentamos constantemente. Por exemplo, ao adicionar gelo a uma bebida começa a haver uma transferência de energia térmica em forma de calor da bebida para o gelo, essa transferência de calor faz com que o gelo aumente sua temperatura até atingir seu ponto de fusão e derreter, o resultado final é que o sistema bebida-gelo atinge seu equilíbrio térmico.
É conhecido como “calor” à transferência de energia entre um sistema e seus arredores devido à diferença de temperatura que existe entre eles. Desta forma, se um sistema tiver uma temperatura mais elevada do que a sua vizinhança, perderá energia na forma de calor e vice-versa. Tudo isso até atingir o equilíbrio térmico com seu ambiente, conforme indicado pela lei zero da termodinâmica.
Quando um sistema evolui de um estado inicial para um estado final, há uma transferência de calor entre o referido sistema e sua vizinhança, mas também o sistema realiza trabalho mecânico em sua vizinhança, tudo isso depende da natureza do processo. Assim, a primeira lei da termodinâmica é definida:
ΔU = ΔQ – ΔW
Onde ΔU é a variação da energia interna do sistema, ΔQ é a transferência de calor e ΔW é o trabalho mecânico. Esta lei afirma que a energia interna de um sistema tende a aumentar se essa energia for adicionada na forma de calor e tende a diminuir se a energia for perdida na forma de trabalho mecânico realizado pelo sistema.
A natureza está repleta de processos irreversíveis. Por exemplo, se um copo cair no chão, ele se parte em vários pedaços, porém, nunca veremos um vidro quebrado se reagrupar espontaneamente e retornar ao seu lugar original. A chave para entender por que alguns processos são irreversíveis está em uma quantidade conhecida como “entropia”.
A primeira lei da termodinâmica estabelece que em todos os processos termodinâmicos há uma conservação de energia, porém, esta lei não estabelece a “direção” para a qual esses processos ocorrem. A entropia estabelece a direção em que os processos termodinâmicos ocorrem e se são ou não reversíveis. A entropia é definida como:
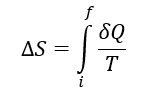
onde ΔS é a mudança na entropia, Q é a energia transferida para ou do sistema como calor e T é a temperatura do sistema. A segunda lei da termodinâmica afirma que a entropia de um sistema fechado sempre aumenta para processos irreversíveis ou permanece constante para processos reversíveis, a entropia nunca diminui.
ΔS ≥ 0
No mundo real, quase todos os processos são irreversíveis devido a fatores como atrito, turbulência, etc., de modo que a entropia de um sistema fechado real sempre aumenta. Processos nos quais a entropia é mantida constante são sempre idealizações.
O salto para a mecânica estatística
A mecânica estatística é o ramo da Física que estuda os sistemas macroscópicos usando as ferramentas da probabilidade e da estatística. A relevância da mecânica estatística reside no fato de que ela estabelece conexões entre processos que ocorrem microscopicamente com grandezas termodinâmicas que podem ser medidas macroscopicamente.
Desta forma, a magnitude macroscópica conhecida como temperatura é uma medida da energia cinética média possuída pelas moléculas que compõem um sistema. A pressão de um gás nada mais é do que uma manifestação do momento linear médio das partículas que o compõem.
A conexão mais interessante entre a mecânica estatística e a termodinâmica ocorre quando se trata do conceito de entropia. Para a mecânica estatística, a entropia é uma medida do grau de desordem que um sistema possui, a entropia na mecânica estatística é expressa como:
S = kB log Ω
onde kB é a constante de Boltzmann e Ω é o número de microestados no sistema em um determinado momento. Assim, a entropia deixa de ser um conceito tão abstrato e a segunda lei da termodinâmica pode ser interpretada como sistemas físicos sempre tendem à desordem.

Artigo de: Ángel Zamora Ramírez. Licenciado em Física. Cursando Mestrado em Engenharia e Física Biomédica.
Referencia autoral (APA): Zamora Ramírez, A.. (Janeiro 2023). Conceito de Termodinâmica. Editora Conceitos. Em https://conceitos.com/termodinamica/. São Paulo, Brasil.